タンパク質間相互作用:NanoBRET™ システム構築の実際 (CRAF-BRAF 相互作用モデル)
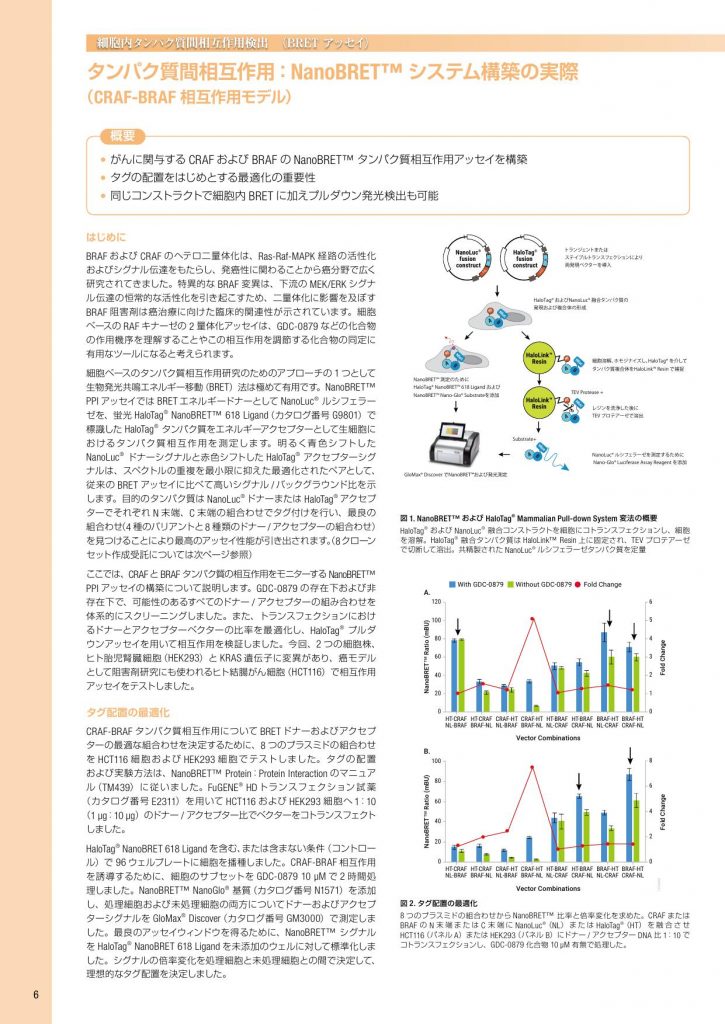
細胞内タンパク質間相互作用検出 (BRET アッセイ) タンパク質間相互作用:NanoBRET™ システム構築の実際 (CRAF-BRAF 相互作用モデル) 概要 • がんに関与する CRAF および BRAF の NanoBRET™ タンパク質相互作用アッセイを構築 • タグの配置をはじめとする最適化の重要性 • 同じコンストラクトで細胞内 BRET に加えプルダウン発光検出も可能 はじめに BRAF および CRAF のヘテロ二量体化は、Ras-Raf-MAPK 経路の活性化 およびシグナル伝達をもたらし、発癌性に関わることから癌分野で広く 研究されてきました。特異的な BRAF 変異は、下流の MEK/ERK シグナ ル伝達の恒常的な活性化を引き起こすため、二量体化に影響を及ぼす BRAF 阻害剤は癌治療に向けた臨床的関連性が示されています。細胞 ベースの RAF キナーゼの 2 量体化アッセイは、GDC-0879 などの化合物 の作用機序を理解することやこの相互作用を調節する化合物の同定に 有用なツールになると考えられます。 細胞ベースのタンパク質相互作用研究のためのアプローチの 1 つとして 生物発光共鳴エネルギー移動(BRET)法は極めて有用です。NanoBRET™ PPI アッセイでは BRET エネルギードナーとして NanoLuc® ルシフェラー ゼを、蛍光 HaloTag® NanoBRET™ 618 Ligand(カタログ番号 G9801)で 標識した HaloTag® タンパク質をエネルギーアクセプターとして生細胞に おけるタンパク質相互作用を測定します。明るく青色シフトした NanoLuc® ドナーシグナルと赤色シフトした HaloTag® アクセプターシグ ナルは、スペクトルの重複を最小限に抑えた最適化されたペアとして、 従来の BRET アッセイに比べて高いシグナル / バックグラウンド比を示 します。目的のタンパク質は NanoLuc® ドナーまたは HaloTag® アクセプ ターでそれぞれ N 末端、C 末端の組合わせでタグ付けを行い、最良の 組合わせ(4 種のバリアントと8 種類のドナー / アクセプターの組合わせ) を見つけることにより最高のアッセイ性能が引き出されます。(8クローン セット作成受託については次ページ参照) ここでは、CRAFと BRAF タンパク質の相互作用をモニターする NanoBRET™ PPI アッセイの構築について説明します。GDC-0879 の存在下および非 存在下で、可能性のあるすべてのドナー / アクセプターの組み合わせを 体系的にスクリーニングしました。また、トランスフェクションにおけ るドナーとアクセプターベクターの比率を最適化し、HaloTag® プルダ ウンアッセイを用いて相互作用を検証しました。今回、2 つの細胞株、 ヒト胎児腎臓細胞(HEK293)と KRAS 遺伝子に変異があり、癌モデル として阻害剤研究にも使われるヒト結腸がん細胞(HCT116)で相互作用 アッセイをテストしました。 タグ配置の最適化 CRAF-BRAF タンパク質相互作用について BRET ドナーおよびアクセプ ターの最適な組合わせを決定するために、8 つのプラスミドの組合わせ を HCT116 細胞および HEK293 細胞でテストしました。タグの配置 および実験方法は、NanoBRET™ Protein:Protein Interaction のマニュア ル(TM439)に従いました。FuGENE® HD トランスフェクション試薬 (カタログ番号 E2311)を用いて HCT116 および HEK293 細胞へ 1:10 (1 µg:10 µg)のドナー / アクセプター比でベクターをコトランスフェクト しました。 HaloTag® NanoBRET 618 Ligand を含む、または含まない条件(コントロー ル)で 96 ウェルプレートに細胞を播種しました。CRAF-BRAF 相互作用 を誘導するために、細胞のサブセットを GDC-0879 10 µM で 2 時間処 理しました。NanoBRET™ NanoGlo® 基質(カタログ番号 N1571)を添加 し、処理細胞および未処理細胞の両方についてドナーおよびアクセプ ターシグナルを GloMax® Discover(カタログ番号 GM3000)で測定しま した。最良のアッセイウィンドウを得るために、NanoBRET™ シグナル を HaloTag® NanoBRET 618 Ligand を未添加のウェルに対して標準化しま した。シグナルの倍率変化を処理細胞と未処理細胞との間で決定して、 理想的なタグ配置を決定しました。 図 1. NanoBRET™ および HaloTag® Mammalian Pull-down System 変法の概要 HaloTag® および NanoLuc® 融合コンストラクトを細胞にコトランスフェクションし、細胞 を溶解。HaloTag® 融合タンパク質は HaloLink™ Resin 上に固定され、TEV プロテアーゼ で切断して溶出。共精製された NanoLuc® ルシフェラーゼタンパク質を定量 HaloTag® fusion construct A HT NanoLuc® fusion construct B NL A HT B A HT B HaloLink™ Resin A HT B HaloLink™ Resin A B A B HT トランジェントまたは ステイブルトランスフェクションにより 両発現ベクターを導入 HaloTag® およびNanoLuc® 融合タンパク質の 発現および複合体の形成 NanoBRET™ 測定のために HaloTag® NanoBRET™ 618 Ligand および NanoBRET™ Nano-Glo® Substrateを添加 GloMax® Discover でNanoBRET™および発光測定 細胞溶解、ホモジナイズし、HaloTag® を介して タンパク質複合体をHaloLink™ Resin で捕捉 レジンを洗浄した後に TEV プロテアーゼで溶出 NanoLuc® ルシフェラーゼを測定するために Nano-Glo® Luciferase Assay Reagent を添加 TEV Protease + Substrate+ 図 2. タグ配置の最適化 8 つのプラスミドの組合わせから NanoBRET™ 比率と倍率変化を求めた。CRAF または BRAF の N 末端または C 末端に NanoLuc® (NL)または HaloTag® (HT)を融合させ HCT116(パネル A)または HEK293(パネル B)にドナー / アクセプター DNA 比 1:10 で コトランスフェクションし、GDC-0879 化合物 10 µM 有無で処理した。 15320MA NanoBRET™ Ratio (mBU) Fold Change CRAF-HT BRAF-NL CRAF-HT NL-BRAF HT-CRAF BRAF-NL HT-CRAF NL-BRAF HT-BRAF NL-CRAF HT-BRAF CRAF-NL BRAF-HT CRAF-NL BRAF-HT NL-CRAF 100 80 60 40 0 20 8 6 4 2 0 B. With GDC-0879 NanoBRET™ Ratio (mBU) Fold Change CRAF-HT BRAF-NL CRAF-HT NL-BRAF HT-CRAF BRAF-NL HT-CRAF NL-BRAF HT-BRAF NL-CRAF HT-BRAF CRAF-NL BRAF-HT CRAF-NL BRAF-HT NL-CRAF 120 100 80 60 40 0 20 5 6 4 3 2 1 0 Without GDC-0879 Fold Change A. Vector Combinations Vector Combinations 6 トランスフェクションの最適化 BRAF-NanoLuc® および CRAP-HaloTag® ベクターをドナー / アクセプター 比 1:1、1:10、1:100 および 1:1,000 で HCT116 および HEK293 細胞 にコトランスフェクトしました。タグ配置の最適化において、GDC-0879 処理(10 µM)または未処理のサンプルを GloMax® Discoverで測定しま した。各ベクター比について処理または未処理サンプル間の倍率変化 を算出しました。 GDC-0879 用量反応曲線 CRAF-BRAF 相互作用の誘導を測定するために、CRAF-HaloTag® および BRAF-NanoLuc® ベクターを HCT116 および HEK293 細胞にコトランス フェクションし、GDC-0879 化合物で処理して用量反応曲線を作成しま した。細胞をドナー / アクセプター比 1:1 または 1:10 でコトランスフェ クションし、細胞を 0.001 µM ~ 10 µM の濃度幅の GDC-0879 化合物で 2 時間処理しました。NanoBRET™ の測定およびシグナルの補正は前述 と同様に行いました。 HaloTag® プルダウンアッセイ CRAF、BRAF タンパク質相互作用を検証するために、HaloTag® Mammalian Pull-Down assay(カタログ番号 G6509)(図 1)の変法を用いた後に、 生物発光で検出しました(Steffen and Méndez-Johnson 2019, tpub_206)。 HCT116 細胞に選択された HaloTag® および NanoLuc® 融合ベクターを ドナー / アクセプター比 1:1 でコトランスフェクションし、細胞を濃度 0、 1 µM または 10 µM の GDC-0879 で処理しました。HaloTag® 融合タンパ ク質を含む細胞溶解を HaloLink™ Resin(カタログ番号 G1912)ととも にインキュベーションした後、ProTEV Plus(カタログ番号 V6101)で消 化しました。共精製された NanoLuc® 融合タンパク質のシグナルを Nano-Glo® Luciferase Assay(カタログ番号 N1110)を用いて検出しました。 結果 GDC-0879 阻害剤存在下で HCT116 および HEK293 でそれぞれ 8 種類 のベクターの組合わせをテストした結果、最高の NanoBRET™ シグナル が得られた組合わせは細胞種により異なり、図 2 で矢印により示しまし た。しかし、阻害剤の処理の有無で最大の倍率変化を示したベクター の組合わせは、最も高いシグナルが得られた組合わせとは異なるという 点は重要です。特異的な CRAF-BRAF 相互作用は化合物で処理した場合 に起こるため、基底レベルが最も低い NanoLuc® と HaloTag® 融合体の 組合わせである CRAF-HaloTag(CRAF-HT C 末端融合体)と BRAF-NanoLuc (BRAF-NL C 末端融合体)が化合物処理により最大の倍率変化と最良 のアッセイウインドウを示しました。このため以降の実験では CRAF-HT および BRAF-NL の組合わせを使用しました。 未結合のドナー量を最小限に抑え、NanoBRET™ シグナルのダイナミッ クレンジを最大にするために、コトランスフェクションするドナーとアク セプターベクター比率を最適化しました。細胞の一部は GDC-0879 で 相互作用を誘導しました。最大の倍率変化が得られたドナー / アクセプ ター比は 1:1 でした(図 3)。 CRAF と BRAF のヘテロ二量体化における GDC-0879 の影響を調べるた めに、様々な濃度の化合物で NanoBRET™ 実験を行いました。図 4 で はベクター比 1:1 および 1:10 での用量反応曲線を示しています。先の 実験と同様に最大のダイナミックレンジはベクター比 1:1 で得られ、同 様の反応が両細胞株で観察されました。これらのデータは、最も効率 的な NanoBRET™ アッセイを行うためにはタグの位置とベクター比の両 方を最適化する必要があることを示していました。さらに、最適化され た NanoBRET™ PPI Assay は、化合物モジュレーターに対して反応する タンパク質相互作用を高感度に検出できる方法であることを示しました。 最後に CRAF-BRAF の相互作用を確認するために、HaloTag® および NanoLuc® タンパク質ならではの利点を利用し、HaloTag® Mammalian Pull-Down の変法および NanoLuc® 融合体の検出を行いました。HCT116 細胞は二量体化を促進させるために様々な濃度の阻害剤で処理しまし た。タンパク質をプルダウンし、切断した後、Nano-Glo® Luciferase Assay を用いて CRAF-HT とともに共精製された BRAF-NL を検出しまし た。ルシフェラーゼのシグナルは HaloTag® コントロールベクターと比較 しました。GDC-0879 を添加しない場合 HaloTag® ベクターコントロール と比べ約 10 倍の BRAF が観察されました(図 5)。GDC-0879 濃度の増 加とともに、BRAF の濃縮倍率も上昇しました。これらのデータは、 NanoBRET™ アッセイで測定されたエネルギー転移の結果が BRAF-NL および CRAF-HT 融合タンパク質間の物理的な相互作用によるものであ ることを裏付けました。 まとめ CRAF-BRAF 相互作用を用いて構築された NanoBRET™ タンパク質間相互 作用アッセイを紹介しました。誘導剤や阻害剤の存在下で、タグの位置 やベクターのコトランスフェクション比率の受容性を示しました。同じ 融合体セット CRAF-HT と BRAF-NL が HTC116 と HEK293 の両細胞で最 も高い倍率変化を示していたことは特筆すべき結果でした。さらに、 GDC-0879 用量依存的にヘテロ二量体化が促進されることを示しまし た。NanoBRET™ テ クノロ ジ ー の もう 1 つ の ユ ニー ク な 特 長 は、 HaloTag® および NanoLuc® が高い応用性を有しており、CRAF-BRAF の エネルギー転移が 2 つのタンパク質間の物理的な相互作用によるもの であることを検証するために HaloTag® プルダウンの変法および NanoLuc® 定量法を利用できることです。 製品名 サイズ カタログ 番号 価格(¥) 特別価格 * (¥) NanoBRET™ 検出試薬 + 空ベクターセット NanoBRET™ PPI MCS Starter System 1 セット N1811 180,000 126,000 NanoBRET™ PPI Flexi® Starter System 1 セット N1821 150,000 105,000 NanoBRET™ アッセイ試薬 NanoBRET™ Nano-Glo® Substrate 50 µl N1571 52,000 36,400 HaloTag® NanoBRET™ 618 Ligand 20 µl G9801 55,000 38,500 プルダウン関連試薬 HaloTag® Complete Pull-Down System 1 セット G6509 175,000 122,500 HaloLink™ Resin 5 ml G1912 35,000 24,500 ProTEV Plus 1000 u V6101 24,500 17,150 Nano-Glo® Luciferase Assay 10 ml N1110 24,000 16,800 *2019 年 8 月 23 日受注分まで 図 5. BRAF-NL の HaloTag® プルダウン 0, 1 µM または 10 µM GDC0879 の存在下で CRAF-HT お よ び BRAF-NL を共発現する HCT116 細胞での NanoLuc® ルシフェラーゼ活性の濃縮倍率 (n = 3)。 Fold Enrichment 1,000 10,000 100,000 100 10 1 No Drug 1µM 10µM [GDC-0879] クローンを作製する時間が無いという方に朗報です! NanoBRET™ に利用できる 8 クローンの作製受託サービスも 承っています。詳細については www.promega.co.jp/pdf/nanoppi_construction_kgt.pdf をご覧ください。 (settled resin 1.25 ml) 図 3. ベクター比率の最適化 NanoBRET™ 比率と倍率変化 は CRAF-HaloTag® と BRAFNanoLuc® プラスミドを比率を 変えて(ドナー / アクセプター 1: 1, 1:10, 1:100 または 1:1,000) HCT116 にコトランスフェク ションした[10 µM GDC-0879 処理(+ / -)](n = 4)。 With GDC-0879 NanoBRET™ Ratio (mBu) Fold Change 1:1 1:10 1:100 1:1000 60 50 70 40 30 20 0 10 6 5 4 7 3 2 1 0 Without GDC-0879 Fold Change A. Donor-to-Acceptor Vector Ratio 図 4. GDC-0879 用量反応曲線 様々な濃度の GDC-0879 化合 物 で NanoBRET™ CRAF-BRAF 相互作用シグナルの倍率変化 を示す。HCT116 細胞へドナー / アクセプターを DNA 比率 1:1 または 1:10 でコトランスフェ クションし、表示濃度の GDC0879 で処理した(n = 4)。 15322MA Fold Change 0.001 0.01 0.1 1 10 10 14 12 16 8 6 4 0 2 B. Log10 [GDC-0879] (µM) 7Promega KWA RBAN
