Promegaならではの高次元細胞実験例を紹介
プロメガの細胞アッセイ ビッグバン
高次元細胞実験プロジェクト ~ 細胞ビッグバン ~
培養細胞を用いた実験系は、最もシンプルな生体システムとして汎用されていますが、これまで同じ細胞サンプルから迅速に、しかもより多くの情報を抽出することは困難でした。また、3次元培養系のアッセイには溶解度の問題から、マーカーの正確な定量が難しいという課題がありました。プロメガではより生体に近い培養細胞実験系を実現するため、高感度な発光法、蛍光法を利用したカイネティックアッセイ、マルチアッセイ、3次元培養アッセイを提案します。
メタボリズムアッセイ
糖尿病やがんなどの種々の疾患において、細胞内の代謝経路が大きく変化していることが明らかになっており、疾患特異的な代謝経路が有用な治療標的となりうると考えられています。プロメガでは、最新の発光技術を利用して、より簡便に、より感度の良い、代謝産物や栄養因子のアッセイシステムを提案します。
Measureの簡単プロトコルでスムーズな測定が可能
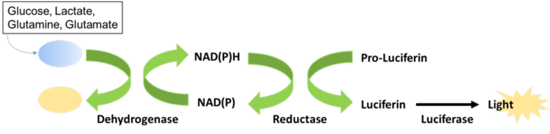
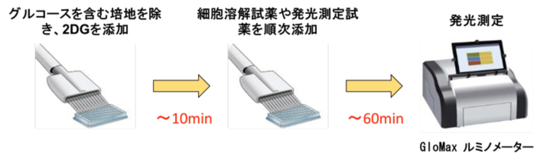
代謝産物や栄養成分に対する特異的デヒドロゲナーゼとリダクターゼを用いた方法により、代謝産物・栄養因子を発光シグナルに変換して測定。Add to Measureの簡単プロトコルで、Glucose Uptake Assayでは約70分で測定可能。
優れた測定感度
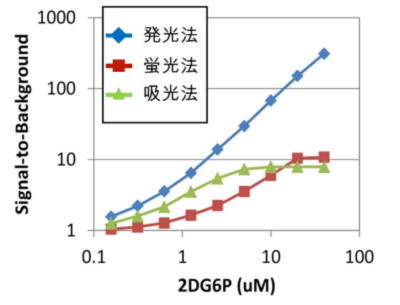
従来法との感度の比較:
各濃度の2DG6Pを用いて、各アッセイ系での感度とアッセイレンジを比較した。従来法である蛍光法(■)や吸光法(▲)と比較して、発光法(◆)は優れたS/B比とアッセイレンジを示す。
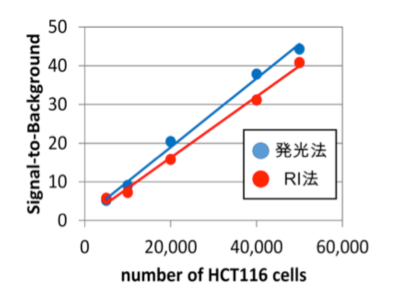
RI法との感度の比較:
HCT116細胞を各細胞数で播種し、1mM 2DGを10分間取り込ませた。発光法(●)はRI法(●)と同等の感度を示す。
同一ウェルでのマルチアッセイ
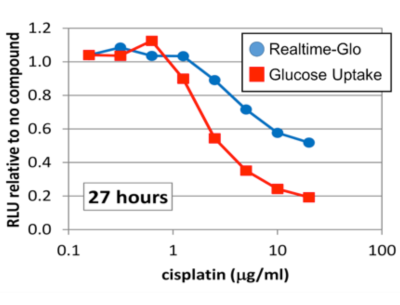
グルコース取り込み能と細胞生存性試験の同一ウェルでのマルチアッセイ:
10,000個のOVCAR-3細胞をRealtime-Glo試薬を含む培地で播種し、各濃度のCisplatinにて27時間処理した。Cisplatin処理後、Realtime-Gloにて生存細胞の測定を行った後、グルコースの取り込み能の評価を行った。
マルチアッセイに関しては こちら
様々な代謝産物・栄養因子の測定例
| 代謝産物・栄養因子 | サンプルの種類 | 製品名 |
|---|---|---|
| Glucose | 細胞:3T3L1-MBX | Glucose Uptake-Glo™ |
| Glucose | 細胞:L6 rat myoblasts | Glucose Uptake-Glo™ |
| Glucose | 培地 | Glucose-Glo™ |
| Lactate | Lactate-Glo™ | |
| Glutamate | Glutamate-Glo™ | |
| Glutamine | Glutamine/Glutamate-Glo™ | |
| Lactate | 組織 | Lactate-Glo™ |
| Glutamate | Glutamate-Glo™ | |
| Glutamine | Glutamine/Glutamate-Glo™ | |
| Glutamate | 細胞 | Glutamate-Glo™ |
| Glutamine | Glutamine/Glutamate-Glo™ |
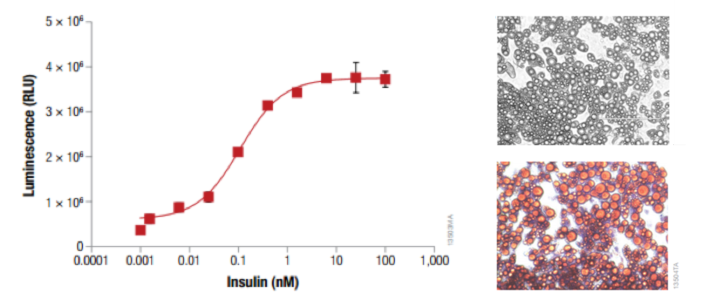
脂肪細胞様の分化モデルを用いたグルコース取り込み能の評価:
| 代謝産物・栄養因子 | Glucose |
|---|---|
| サンプルの種類 | 細胞:3T3L1-MBX |
| 製品名 | Glucose Uptake-Glo™ |
3T3L1-MBX細胞を20,000 cells /100μlで 96-well
plateに播種し、Insulin、Isobutylxanthine、Dexamethasone、Rosiglitazoneを含む培地で、脂肪細胞様に分化誘導した。分化誘導後、種々の濃度のInsulinを含むDMEM培地
100uLに培地交換し、37℃, CO2インキュベーターで1時間インキュベート。培地を除き、2-DGを含んだPBS 50uLを加え、Glucose Uptake-Glo™
Assayにて発光測定を行った。(左図)
分化誘導を行った後の顕微鏡下写真。明視野(右上)、およびoil red染色(右下)より、分化誘導した3T3L1-MBX細胞において、脂肪滴の形成が観察される。
筋管細胞の分化モデルを用いたグルコース取り込み能の評価:
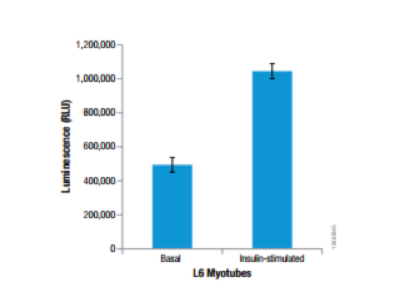
| 代謝産物・栄養因子 | Glucose |
|---|---|
| サンプルの種類 | 細胞:L6 rat myoblasts |
| 製品名 | Glucose Uptake-Glo™ |
L6 rat myoblastsを10% FBSを含むDMEMにて5,000 cells /100μlで96-well plateに播種。その後、低血清下の条件で3日間、分化誘導を行った。アッセイ前日に無血清のDMEM培地に交換し、種々の濃度のInsulinを含むDMEM培地 100uLに培地交換し、37℃, CO2インキュベーターで1時間インキュベート。培地を除き、2-DGを含んだPBS 50uLを加え、Glucose Uptake-Glo™ Assayにて発光測定を行った。
細胞培養上清中に存在する各栄養因子の測定
A549細胞を5mM glucose, 2mM glutamine, 10% dialyzed serumを含むDMEM培地にて、 15,000 cells /100μlもしくは5,000 cells /100μlの条件で96well plateに播種した。8,24,48,72時間後に2.5uLの培地を取り、97.5μl PBS で希釈し、すべてのサンプルがそろうまで凍結保存した。最後のサンプルの回収後、各測定キットにて発光測定を行った。濃い色の棒グラフは15,000 cells /100μlを示し、淡い色の棒グラフは5,000 cells /100μlの条件を示す。赤い点線は培地のみのコントロールの発光値を示す。
Glucose 培地 Glucose-Glo™
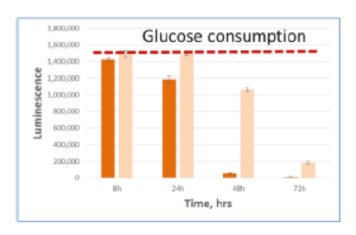
| 代謝産物・栄養因子 | Glucose |
|---|---|
| サンプルの種類 | 培地 |
| 製品名 | Glucose-Glo™ |
Lactate 培地 Lactate-Glo™
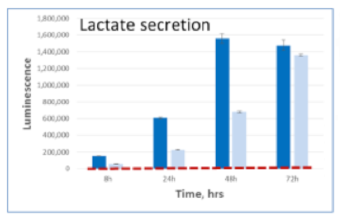
| 代謝産物・栄養因子 | Lactate |
|---|---|
| サンプルの種類 | 培地 |
| 製品名 | Lactate-Glo™ |
Glutamate 培地 Glutamate-Glo™
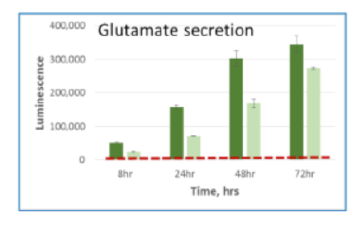
| 代謝産物・栄養因子 | Glutamate |
|---|---|
| サンプルの種類 | 培地 |
| 製品名 | Glutamate-Glo™ |
Glutamine 培地 Glutamine/Glutamate-Glo™
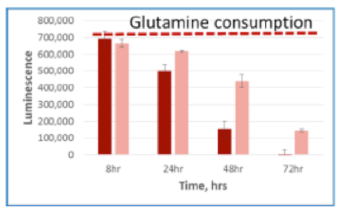
| 代謝産物・栄養因子 | Glutamine |
|---|---|
| サンプルの種類 | 培地 |
| 製品名 | Glutamine/Glutamate-Glo™ |
組織サンプル中の栄養因子の測定:
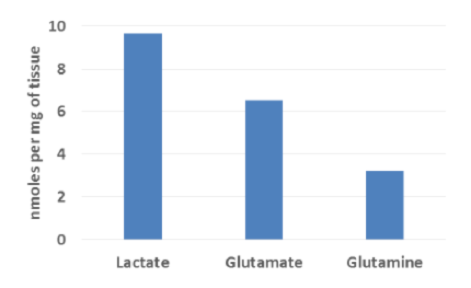
| 代謝産物 栄養因子 |
サンプルの種類 | % Recovery | 製品名 |
|---|---|---|---|
| Lactate | 組織 | 105% | Lactate-Glo™ |
| Glutamate | 88% | Glutamate-Glo™ | |
| Glutamine | 107% | Glutamine Glutamate-Glo™ |
凍結脳サンプル(~10mg)のホモジネートを作製し、各栄養因子の測定を行った。右表% Recoveryは各アッセイにおける、各栄養因子の回収率を示す。
細胞内のグルタミンおよびグルタミン酸の測定:
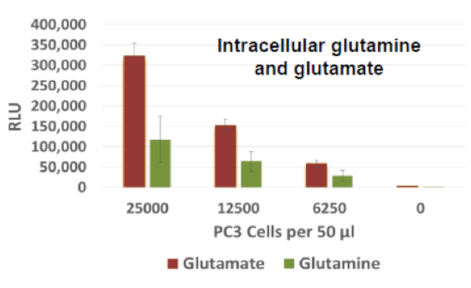
| 代謝産物・栄養因子 | サンプルの種類 | 製品名 |
|---|---|---|
| Glutamate | 細胞 | Glutamate-Glo™ |
| Glutamine | Glutamine/Glutamate-Glo™ |
PC3細胞を各細胞数で96well plateに播種し、同一のセルライセートを作製した。発光にて細胞内のグルタミン酸およびグルタミンの量の測定を行った。
カイネティック解析
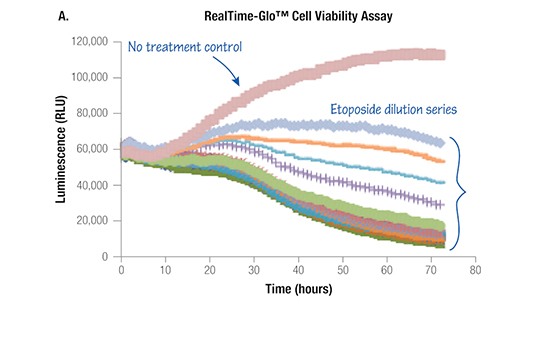
細胞の毒性評価手法はMTTアッセイ法をはじめ、様々な改良が加えられ進化しています。近年、単にエンドポイントの細胞毒性を測定するだけでなく、経時変化を測定することにより、より正確な毒性評価することが重要であると考えらえてきています。プロメガでは、最新の発光・蛍光技術を利用した、より簡便に、より感度の良い、細胞毒性の経時測定用試薬を提案します。
タイムコースを取らなければわからないこと
RealTime-Glo™ MT Cell Viablity Assay
Time-dependent tox profiles from single sample set (K562 cells)
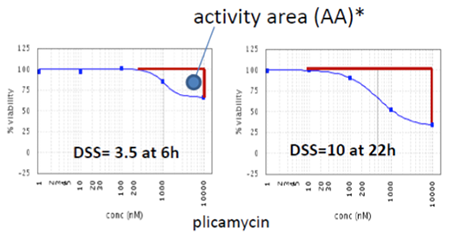
RealTime-Gloを用いて、様々な薬剤について各タイムポイントにおける容量反応曲線および毒性の強さ(activity area)を作成し(左図)、表にした(下図)。エンドポイントでは同等の毒性を示す薬剤でも、初期のタイムポイントでは毒性の大きさが異なることが分かる。
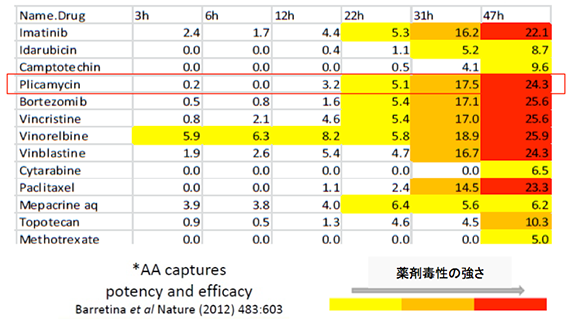
タイムコースを測ることにより、薬剤の毒性をより正確に評価/分類できる
タイムコース実験が簡単に!
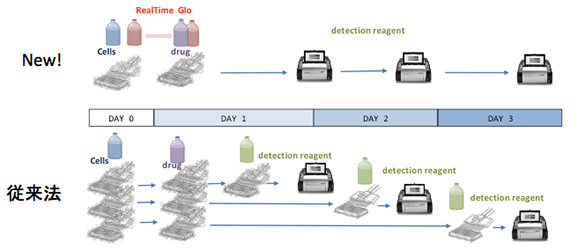
従来のタイムコース実験では各タイムポイントごとにプレートを用意する必要がありました。RealTime-Glo, CellTox-Greenは細胞播種時、または薬剤添加時に試薬を添加するだけで、同一ウェルでの細胞生存性および毒性のタイムコース実験が可能です。
実施例
プロメガのRealTime-GloとCellTox Greenなら、試薬を添加するだけでリアルタイムでアッセイが可能
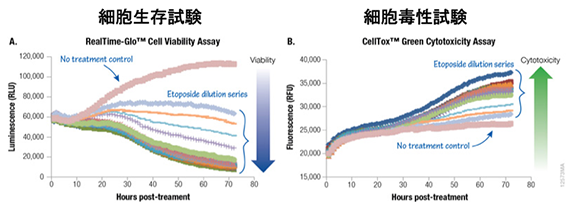
384ウェルプレート1ウェルあたり500個のA549細胞を播種し、2X RealTime-Glo™ ReagentおよびCellTox Greenを含む培地40µlを添加した。等量の2X エトポシド を添加し、発光および蛍光を72時間にわたりモニタリングした。
もっと長時間アッセイも可能!
RealTime-Glo™ MT Cell Viability Assay
長期間のRealTime-Gloアッセイ例
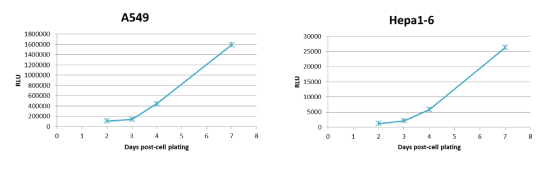
1)7日までの発光測定例:
- A549細胞およびHepa1-6細胞を1,000 cells/wellの条件で、培地80uLにて384well plateに播種。
- 細胞播種後2日目に、培地16uLを除く。その後、5x RealTime-Glo reagentsを含む培地16uLを添加する。
- 細胞を1~2時間、インキュベートし、プレートリーダーで発光を測定する。
- 発光測定後、RealTime-Glo reagentsを含む培地を除き、新しい培地に交換する。
- 細胞播種後3,4,7日目も同様の手順でプレートリーダーにて発光を測定する。
(*)本実験で使用したA549細胞(上図)は還元能が高く、発光値が高い細胞株です。RealTime-Gloは生細胞の還元能を用いた測定であり、培養条件(培地中の栄養状態・老廃物の蓄積等)により、還元能に影響が出て、発光値の測定に影響が生じる可能性があります。上記の手順であれば、細胞が増加した状態でも、安定した発光値の測定が可能となります。また、発光値が低いHapa1-6細胞(下図)においても同様の測定が可能です。
2)72時間以上の連続発光測定例:
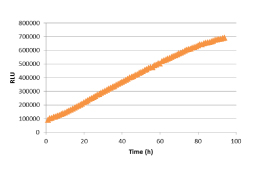
A549細胞を500 cell/wellの条件で、1x RealTime-Glo reagentsを含む培地80uLにて384well plateに播種。
Tecan
M200を用いて、37℃,5% CO2下にて96時間まで連続して発光測定。
(*)上記の実験では、Tecan
M200を用いて連続測定を行っています。細胞数等の条件を調整頂くことで、一般的なプレートリーダーにおいて、通常のプロトコルでの連続発光測定を行うことも可能です。
マルチアッセイ
1つのプレートの各ウェル内で複数マーカーを同時に測定するマルチアッセイは、データの精度を向上させることができると同時に貴重なサンプル、時間や費用を節約すことができます。現在、正確な生物学的情報を取得するために、生存性、アポトーシス、細胞毒性(ネクローシス)およびレポーター活性などのパラメータが用いられ、それらのマーカー(細胞内在性/外来性) の測定が行われています。これらのパラメータのいくつかを統合あるいは多重化してアッセイすることにより、1回の実験からより多くの情報を得ることができます。2つの異なるレポーター酵素(細胞外来性マーカー)を測定するデュアル-ルシフェラーゼアッセイシステムはプロメガで開発され、分子生物学から細胞生物学における幅広い分野で利用されています。プロメガでは、これまでに蓄積された細胞ベースのアッセイ技術から新規バイオマーカーの創出、同時多項目解析を可能にするマルチアッセイ技術の開発を行い、培養細胞を用いた優れたアッセイ系を提案しています。
マルチアッセイとは
同一サンプルから複数のパラメータを得る
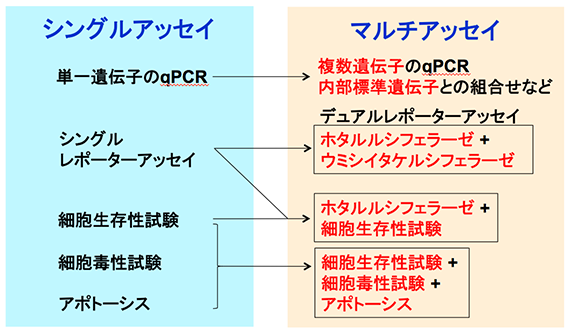
マルチアッセイを行うメリット
実験データの情報量が向上
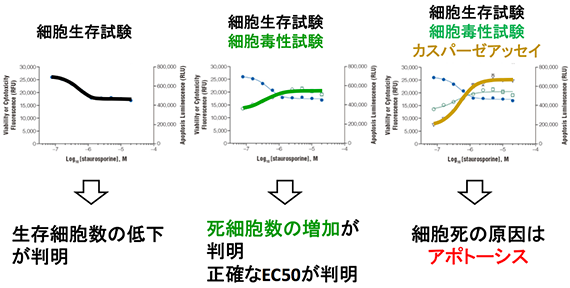
同一ウェルで複数のマーカーを測定することにより、細胞に対する評価物質の影響を多角的に評価することができます。
実験データの信頼性が向上
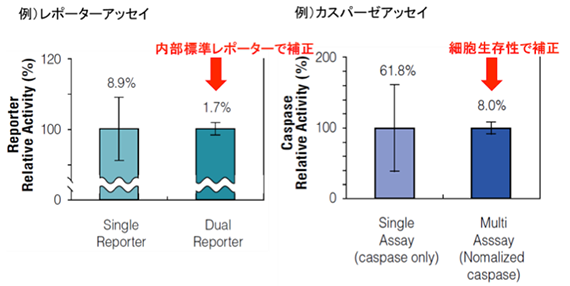
評価指標に対して、内部標準レポーター、生細胞数で補正することにより、ウェル間の誤差を最小限にし、信頼性の高いデータを示すことができます。
コスト・労力の削減
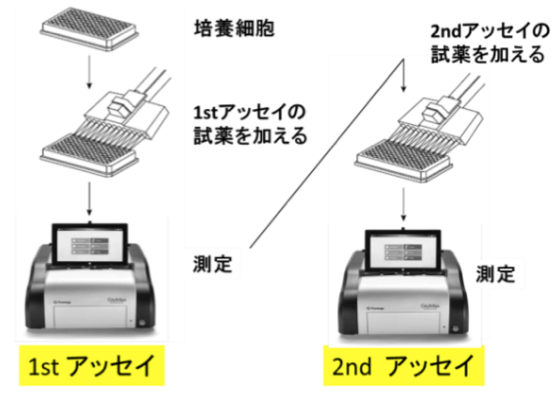
- 貴重な細胞の使用を最小限に
- プレート、チップ、試薬コストの削減
- 培養細胞の準備、アッセイ時間の削減
RealTime-Gloで様々なマルチアッセイが可能に!
これまでのアッセイでは出来なかった、発光×発光での検出
ルミノメーターだけのMultiplexアッセイができます!
| 1st アッセイ | 2nd アッセイ | 得られる情報 |
|---|---|---|
| RealTime-Glo™ |
CellTox™ Green |
細胞生存性と細胞毒性(細胞膜の完全性:DNA の漏出) |
| CytoTox-Fluor™
|
細胞生存性と細胞毒性 (細胞膜の完全性:細胞内プロテアーゼの漏出) |
|
| CellTiter-Glo®
|
2 つの細胞生存性マーカー(還元能と ATP) 幹細胞からの分化状態の実験などに! |
|
| NAD/NADH-Glo™
|
細胞生存性と NAD+ および NADH | |
| NADP/NADPH-Glo™
|
細胞生存性と NADP+ および NADPH | |
| Firefly Reporter Assay
|
細胞生存性とレポーター活性 | |
| RNAの精製 | 細胞生存性と RNA 分析 |
その他のマルチアッセイ製品
| 製品名 | マーカー | 検出 | 検出までの時間 | 感度 | |
|---|---|---|---|---|---|
| 細胞死メカニズム(マルチアッセイ) | |||||
| アポトーシス細胞/生細胞/死細胞 | ApoTox-Glo™ Triplex Assay |
LCP/DCP/カスパーゼ | 蛍光(Ex400/Em505) /(Ex485/Em520)/発光 |
1時間 | 生細胞40個/死細胞10 /アポトーシス細胞20個 |
| アポトーシス細胞/生細胞 | ApoLive-Glo™ Multiplex Assay |
LCP/カスパーゼ | 蛍光(Ex400/Em505)/発光 | 30分間 | 生細胞40個 /アポトーシス細胞20個 |
| 生細胞/死細胞 | MultiTox-Fluor Assay |
LCP/ DCP |
蛍光(Ex400/Em505) /(Ex485/Em520) |
30分間-3時間 | 生細胞40個/死細胞10個 |
| MultiTox-Glo Assay | LCP/DCP | 蛍光(Ex400/Em505)/発光 | 30分間 | 生細胞40個/死細胞10個 | |
| ミトコンドリア毒性 (死細胞/ミトコンドリア活性) |
Mitochondrial ToxGlo™ Assay |
DCP/ATP | 蛍光(Ex485/Em520)/発光 | 30分間 | - |
3次元培養細胞アッセイ
3次元培養によるガン毒性スクリーニングの進歩

初代培養細胞や細胞株を用いた実験手法は長い間、細胞増殖及びアポトーシスに関わる薬剤スクリーニングの主流でした。しかしながら、標準的な細胞培養は培養底面の二次元的な単層であり、実際の生体内の状態とは大きな乖離がありました。近年、より生体組織に近い培養系として、スフェロイド培養が多く用いられています。スフェロイド培養は、生体組織に近い性質を持ちつつ、ハイスループットスクリーニングに応用できる利点があります。プロメガはこのようなスフェロイド培養において、細胞内の各種マーカーを正確かつ簡便にできるアッセイ試薬を提案します。
優れた溶解力で芯まで溶かす!
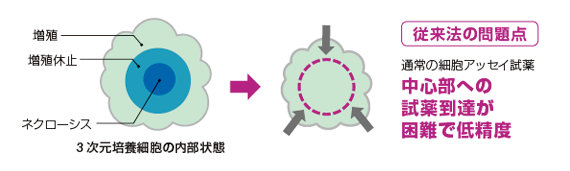
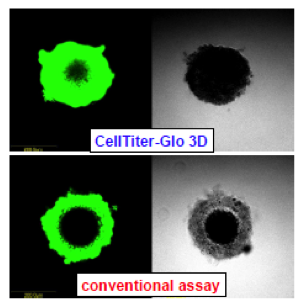
ハンギングドロッププレートにHCT116細胞400個を播種し、4日間培養して直径300umのスフェロイドを形成させた。CellTiter-Glo 3Dおよび従来試薬添加前に、DNAに結合して蛍光をもつCellTox Greenを添加した。試薬添加後30分後に共焦点蛍光顕微鏡で撮影した。従来法に比べ、CellTIter-Gloを添加したスフェロイドでは、中心部まで浸透していることが分かる。
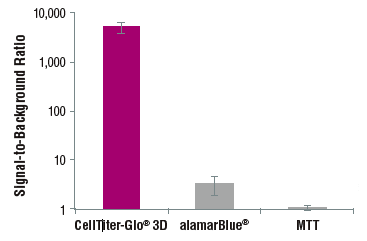
発光法により従来のMTT法に比べて高感度!
スフェロイドを用いた各細胞生存試験の感度の違い
96-ウェルGravutyPLUS™ハンギングドロッププレート(InSphero AG)に400個のHCT116大腸がん細胞を播種し、4日間インキュベーションした。各メーカーのプロトコルに従いスフェロイド(〜340μm)を測定した。CellTiter-Glo®3D,alamarBlue®およびMTTのアッセイ時間はそれぞれ30分間、3時間、8時間(MTTアッセイの4時間とSDSによる可溶化4時間の合計)。
細胞培地に試薬を1回加えるだけの簡単操作!
様々な細胞マーカーの3次元培養系における検出例
| 培養法 | 細胞種 | 検出対象 | 製品名 |
|---|---|---|---|
| マトリゲル培養 | HCT116 他 | 生細胞 | CellTiter-Glo® 3D |
| FCeM | SKOV3 | 生細胞 | CellTiter-Glo™ |
| ELPLASIA | DU145 | 生細胞 | CellTiter-Glo® 3D |
| Corning Spheloid Microplate | HT29 他 | 生細胞 | CellTiter-Glo® 3D |
| ハンギングドロップ法 | HCT116 | 死細胞 | CellTox™ Green Cytotoxicity Assay |
| ハンギングドロップ法 | HCT116 | カスパーゼ | Apo-ONE™ Homogeneous Caspase-3/7 Assay* |
| ハンギングドロップ法 | HCT116 | グルタチオン | GSH/GSSG-Glo™ |
| ハンギングドロップ法 | HCT116 | NAD(P), NAD(P)H | NAD(P)/NAD(P)H-Glo™ |
| ハンギングドロップ法 | HCT116 | レポーターアッセイ | Nano-Glo® |
| 3D bioprinting法 | HepG2 | 生細胞 | CellTiter-Glo® Cell Viability Assay |
| 3D bioprinting法 | HepG2 | 生細胞 | RealTime-Glo™ MT Cell Viability Assay |
| Tumore Organoids | ヒトがん組織 | 生細胞 | RealTime-Glo™ MT Cell Viability Assay |
| 低接着プレート | HCT116 他 | アポトーシス | RealTime-Glo™ Annexin V Apoptosis and Necrosis Assay |
| 低接着プレート | HCT116 | 死細胞 | LDH-Glo™ Cytotoxicity Assay |
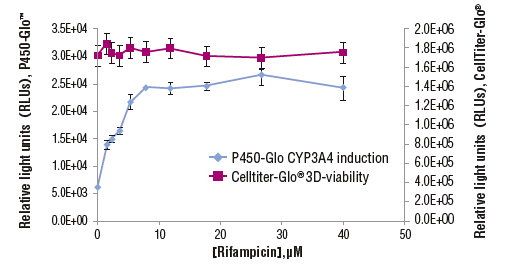
| 組織培養 | ヒト肝臓組織 | P450 3A4 | P450-Glo™ |
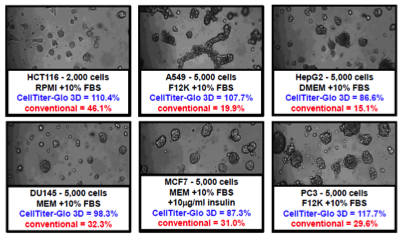
マトリゲル培養における各種細胞種のATP回収率比較
| 培養法 | マトリゲル培養 |
|---|---|
| 細胞種 | HCT116 他 |
| 検出対象 | 生細胞 |
| 製品名 | CellTiter-Glo® 3D |
6種類の細胞腫(HCT116, A549, HepG2, DU145, MCF7, PC3)についてMatrigelコートしたプレートに4日間培養し、CellTiter-Glo 3Dおよび他社ATP検出試薬でアッセイを行った。%recoveryはTCA抽出で得られたATPの測定値に対する各アッセイにおける測定値の割合を示す。 CellTiter-Glo 3DではTCA抽出と同等の結果が得られた。
EGF受容体リガンドとTGF-βによるSKOV3細胞の足場非依存性増殖の評価
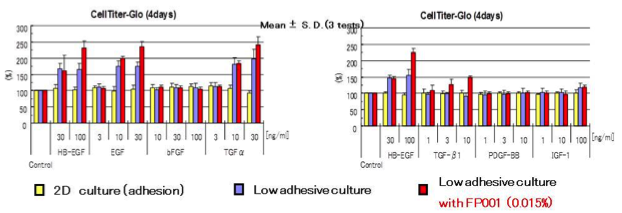
| 培養法 | FCeM |
|---|---|
| 細胞種 | SKOV3 |
| 検出対象 | 生細胞 |
| 製品名 | CellTiter-Glo™ |
三次元培養培地FCeMでヒト卵巣癌由来SKOV3細胞を4日間、各種増殖因子とともに培養し、CellTiter-Gloで細胞生存性を定量した。
ヒト前立腺がん細胞DU145に対する5-FUの毒性評価
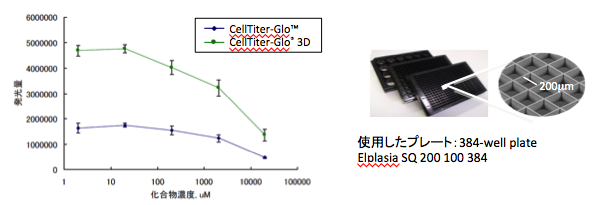
| 培養法 | ELPLASIA |
|---|---|
| 細胞種 | DU145 |
| 検出対象 | 生細胞 |
| 製品名 | CellTiter-Glo® 3D |
三次元培養用細胞培養プレートELPLASIAにDU145細胞を培養し、5-FUを培養7日目に暴露した。9日目にCellTiter-Glo 3DおよびCellTiter-Gloで生存率測定(暴露期間48時間)した。
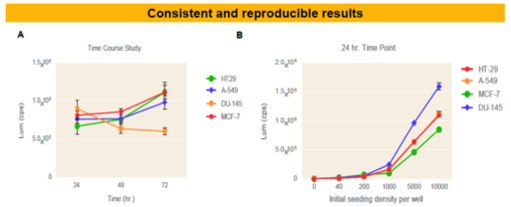
Corning Spheloid Microplate において、4種類の細胞腫(HT29, A-549, DU-145,
MCF-7))を培養し、CellTiter-Glo
3Dで細胞生存性を測定した。(A)タイムコース実験:5,000細胞を播種し、各タイムポイントで生存性を測定した。(B)スフェロイド形成能の評価:異なる細胞数で播種し、24時間後に細胞生存性を測定した。
TKIT Library Screen: 2次元培養および3次元培養において、Tocriscreen Kinase
InhibitorToolboxライブラリーに対する細胞毒性評価を、CellTiter-Glo 3D用いて行った。Corning Spheloid Microplateを用いたCellTiter-Glo® 3Dの実施例
培養法
ELPLASIA
細胞種
DU145
検出対象
生細胞
製品名
CellTiter-Glo®
3D
マイクロティッシュにおける細胞毒性の測定
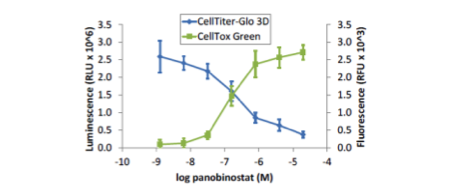
| 培養法 | ハンギングドロップ法 |
|---|---|
| 細胞種 | HCT116 |
| 検出対象 | 死細胞 |
| 製品名 | CellTox™ Green Cytotoxicity Assay |
HCT116細胞をInSphero GravityPLUS 96-well hanging-dropで4日間培養した。マイクロティッシュをDNA結合性細胞毒性試験試薬CellTox Greenとともにpanobinostatで48時間処理した。蛍光測定後、等量のCellTiter-Glo 3Dを添加し、5分間振盪後、発光測定した。
マイクロティッシュにおけるカスパーゼ活性の測定
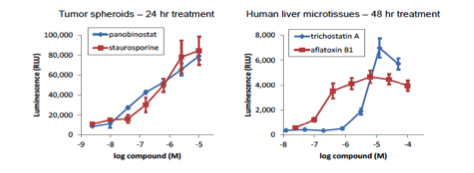
| 培養法 | ハンギングドロップ法 |
|---|---|
| 細胞種 | HCT116 |
| 検出対象 | カスパーゼ |
| 製品名 | Apo-ONE™ Homogeneous Caspase-3/7 Assay* |
InSphero GravityPLUS 96-well hanging-dropで4日間培養したHCT116細胞(~340um径) 、およびヒト肝組織(~275um径)を各薬剤で一定時間処理後、等量のCaspase-Glo 3/7を添加し、30分間振盪後、発光測定した。
マイクロティッシュにおける細胞内グルタチオン総量の測定
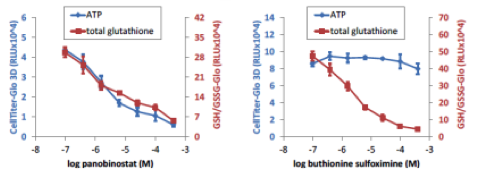
| 培養法 | ハンギングドロップ法 |
|---|---|
| 細胞種 | HCT116 |
| 検出対象 | グルタチオン |
| 製品名 | GSH/GSSG-Glo™ |
InSphero GravityPLUS 96-well hanging-dropで4日間培養したHCT116細胞(〜340um径)を各薬剤で48時間処理後、CellTiter-Glo 3DおよびGSH/GSSG-Gloでそれぞれ細胞生存性、総グルタチオン量を測定した。
マイクロティッシュにおける細胞内NAD, NADH, NADP, NADPH量の測定
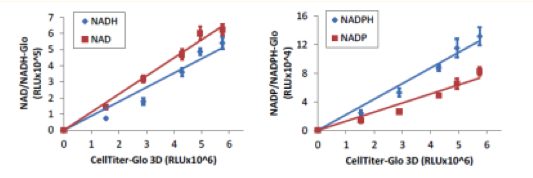
| 培養法 | ハンギングドロップ法 |
|---|---|
| 細胞種 | HCT116 |
| 検出対象 | NAD(P), NAD(P)H |
| 製品名 | NAD(P)/NAD(P)H-Glo™ |
各細胞数のHCT116細胞をInSphero GravityPLUS 96-well hanging-dropで4日間培養した。各細胞数のウェルについて、CellTiter-Glo 3Dで発光測定を行った。各細胞数の別ウェルでNAD/NADH-GloでNADおよびNADHの測定を、 NADP/NADPH-GloでNADPおよびNADHPの測定を行った。
マイクロティッシュにおける 細胞内NAD, NADH, NADP, NADPH量の測定
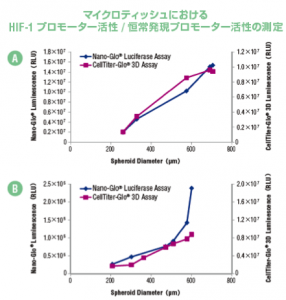
| 培養法 | ハンギングドロップ法 |
|---|---|
| 細胞種 | HCT116 |
| 検出対象 | レポーターアッセイ |
| 製品名 | Nano-Glo® |
A 恒常発現プロモーターまたは B HIF-1 プロモーターにより駆動する NanoLuc®
ルシフェラーゼ遺伝子を含む HCT116 細胞を4日間 InSphero GravityPLUS™ 3D 細
胞培養システムで培養したマイクロテッシュ(約200〜700 μm)を調製し、NanoGlo®
または CellTiter-Glo® 3D でレポーター活性および細胞生存性を測定した。パネル B
ではマイクロティッシュの直径が大きくなるほど酸化ストレスが増加した。