進化したレポーター実験完全サポートプログラム




「実験目的に合ったタンパク質タグ/プロテインレポーターはどれだろう?」
「プロモーター・応答配列はどの部分をクローニングしたらよいの?」
「レポーター実験のやり方が分からない!」などお悩みの方
導入配列、ベクターも決まって、ベクター構築受託の見積金額、納期が知りたい方


NanoLuc® 実験レポーター(一例)
| 応答配列導入ベクター(各¥ 80,000 程度) | ||||
|---|---|---|---|---|
| AP1 | CRE | MycMax | SRE | ARE |
| GAS | NFAT | SRF | ATF4 | HRE |
| p53 | STAT5 | ATF6 | ISRE | SBE |
| TCF/LEF | CEBP | MRE | SIE | XRE |
相談フォームまたは見積りフォームをご利用ください。
ジェネティックレポーター
ジェネティックレポーターとは
レポーターアッセイといえば、プロモーター解析やシグナル伝達研究などに利用されているホタルルシフェラーゼがジェネティックレポーターとして広く利用されてきました。
このジェネティックレポーターは、レポーターベクターに導入した転写制御配列(プロモーターや応答配列)に対応する一連のシグナル経路(刺激[薬剤/ホルモン]→ 受容体 → シグナル因子 → 転写因子→ 制御配列etc)に及ぼされる変化(正/負の調節など)をレポータータンパク質の活性として定量する手法です。
これまでにプロモーター解析など転写に関わる基礎研究をはじめ、特定のシグナルに影響する薬剤のスクリーニングなどに使用されています。近年では特定の受容体と応答配列を組み合わせた遺伝子改変細胞がバイオセンサー(ADCCアッセイetc)として利用されるなど様々な分野で応用されています。
| 製品名 | カタログ番号 | サイズ |
|---|---|---|
| Nano-Glo® Dual-Luciferase® Reporter Assay/pGL4.54[luc2/TK] Bundle | N1541 | 1セット |
| Nano-Glo® Dual-Luciferase® Reporter Assay/pGL4.53[luc2/PGK] Bundle | N1551 | 1セット |
NanoLuc®で変わるレポーターの世界
ホタルルシフェラーゼはシングルレポーターアッセイとしてあるいは、ウミシイタケルシフェラーゼを内部標準として組み合わせたデュアルアッセイとしても一般的に用いられるようになりました。プロメガではより真のバイオロジーを解析できる高感度な発光レポーターとしてNanoLuc®を開発しました。NanoLuc® レポーターは深海エビ(トゲオキヒオドシエビ[Oplophorus gracilirostris])に由来する19 kDaの小型発光酵素で、ホタルの100倍以上の発光強度をほこります。これらの特長はレポーターの性能を飛躍的に向上させ、アプリケーションを拡充しました。
ジェネティックレポーターとして従来のレポーター酵素からの改良点:
- トランスフェクションの困難な細胞、少数の細胞でも十分なシグナルが得られる
- 使用するベクターや細胞、被検化合物の量を低減可能
- より微細な細胞内変化をとらえることができる
- ホタルルシフェラーゼのクエンチング効率が飛躍的に改善され、より正確なデュアル測定が可能に(Nano-Glo® Dual)
プロテインレポーター
プロテインレポーターとは
プロテインレポーターとは標的タンパク質に融合させ、その挙動を容易に検出するための機能性タンパク質です。プロメガでは各種発光レポーターやイメージング・ 精製などに利用できるユニークな 受け皿タンパク質HaloTag® をラインナップにそろえています。また発光酵素NanoLuc® をサブ ユニット化したSmBiT、HiBiT、LgBiTを用いれば、タンパク質間相互作用やタンパク質の発現・分解などを高感度に定量することができます。
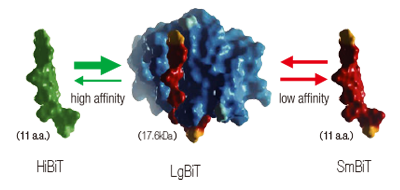
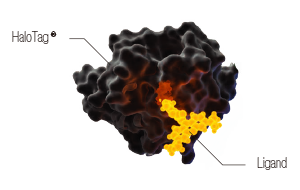
NanoLuc ®
(発光酵素:ホタルの100倍の発光強度)
深海エビに由来する分子量約19kDaの小型の発光酵素で従来のルシフェラーゼの発光強度を大きく上回ります。
- タンパク質の定量・検出(発現、安定化、分解)
- BRETのドナー光源として(化合物:タンパク質相互作用)
- 発光イメージング
LgBiTと SmBiT/HiBiT
(NanoLuc® のサブユニット)
NanoLuc® を大小のサブユニットに分け、近接あるいは結合することで発光酵素として再構成(ホタルの約30倍の発光強度)されます。小サブユニットには大サブユニットLgBiT(共通)との親和性が異なる2つのタイプHiBiT(高親和性)および SmBiT(低親和性)があり、2つのペアは異なる細胞内イベントの検出に利用することができます。小サブユニットはどちらも11アミノ酸と非常に小さいため、本来のタンパク質機能への影響は最低限で、CRISPRによる内在ローカスへの導入も容易です。
HiBiT
- タンパク質の検出・定量
- ウイルス感染
- 細胞融合
SmBiT
- タンパク質間相互作用検出
- 分子重合(RealTime-Glo™ Apoptosis Assay)
HaloTag®
HaloTag® 低分子機能性リガンドと特異的に結合する約30kDaの受け皿タンパク質です。タンパク質解析ツールとして様々な機能性リガンドをご用意しています。
- 蛍光イメージング、パルスチェイス様実験
- BRETにおけるアクセプター
- リガンド担体を利用した精製、プルダウン実験など
| 製品名 | 検出レポーター | カタログ番号 | サイズ |
|---|---|---|---|
| Nano-Glo® Luciferase Assay | NanoLuc® | N1110 | 10 ml |
| Nano-Glo® HiBiT Lytic Detection System | HiBiT | N3030 | 10 ml |
| Nano-Glo® HiBiT Extracellular Detection System | N2420 | 10 ml | |
| Nano-Glo® HiBiT Blotting System |
N2410 | 100 ml | |
| NanoBRET™ Nano-Glo® Detection System | NanoLuc® + HaloTag® | N1661 | 200 回分 |
| HaloTag® TMR Ligand | HaloTag® | G8252 | 15 µl |
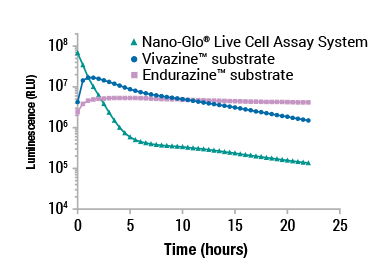
Nano-Glo® Live Cell Assay System、Endurazine™、Vivazine™ の発光カイネティクス比較
イムノアッセイでは不可能なダイナミックな細胞内イベントを経時的にモニタリング
各種Nano-Glo® Live Cell SubstrateはNanoLuc® 酵素あるいはNanoBiT®バイナリー酵素(SmBiT+LgBiTまたはHiBiT+LgBiT)に対する細胞透過性の発光基質です。また、LgBiT Expression Vectorを細胞内に導入し、LgBiTを安定に供給することでHiBiT融合タンパク質のライブセルアッセイを実現できます(LgBiT安定発現細胞株については別途お問合せください)。
| 製品名 | カタログ番号 | サイズ | |
|---|---|---|---|
| ライブセルアッセイ用細胞透過性 NanoLuc® 発光基質 | |||
| Nano-Glo® Live Cell Assay System | N2011 | 100回分 | |
| Nano-Glo® Endurazine™ Live Cell Substrate | N2570 | 0.1ml | |
| Nano-Glo® Vivazine™ Live Cell Substrate | N2580 | 0.1 ml | |
| Nano-Glo® Extended Live Cell Substrate Trial Pack | N2590 | 0.2 ml | |
| HiBiTライブセルアッセイ用 LgBiT供給用発現ベクター | |||
| LgBiT Expression Vector | N2681 | 20 µg | |
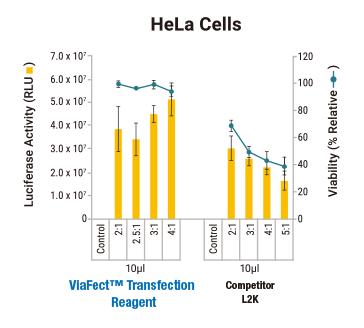
ViaFect™ と他社トランスフェクション試薬
の導入効率と細胞生存性の比較
トランスフェクション試薬
細胞にやさしい × 高感度レポーター リアル バイオロジー
| 製品名 | カタログ番号 | サイズ |
|---|---|---|
| FuGENE® HD Transfection Reagent | E2311 | 1 ml |
| ViaFect™ Transfection Reagent | E4981 | 0.75 ml |
CRISPR ゲノム編集 でより内在的なアッセイが可能
CRISPR/Cas9ゲノム編集を利用して標的遺伝子の内在ローカスにHiBiT レポーターなどをノックインすれば、ネイティブプロモーターによって発現されるタンパク質を、発光により定量することができます。過剰発現モデルと比較して、内在的に標識されたタンパク質は、自然なエピジェネティック制御とネイティブの相互作用パートナーとの化学量論を維持し、より真のバイオロジーを反映した正確なモデルとして利用することができます(参考文献: Schwinn MK, Steffen LS, Zimmerman K, Wood KV, Machleidt T. Sci Rep 2020-06-02. )。
プロメガでは HiBiT などをゲノム編集により導入した細胞を揃えています。
これらの編集済み細胞リストについては こちら をご覧ください。