SLAS2016 ポスター情報
プロメガテクノロジー発表ポスター集
#2066 Bioluminescent Assay for GTPases Allows Measurement of GTPase, GAP
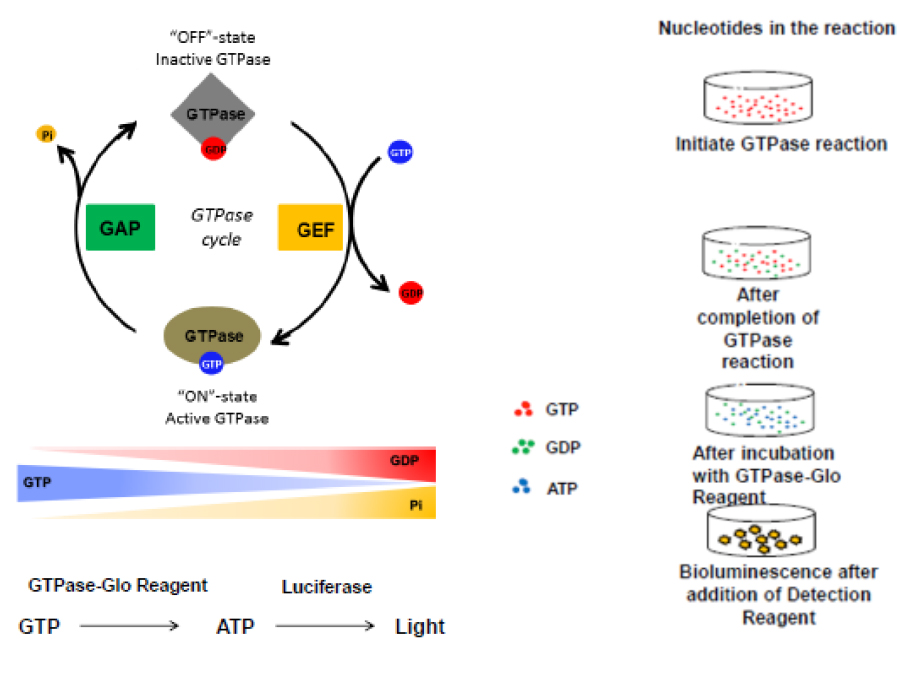
GTPaseはシグナリング、細胞増殖、細胞骨格制御、細胞遊走など多様な細胞機能において主要な役割を果たしており、GTPase制御不全や変異は疾患の原因であるため、GTPaseは重要な創薬ターゲットです。しかしこれまでHTS対応のGTPaseアッセイは技術的に困難でした。このポスターでは発光法を用いたHTS対応のGTPase活性測定アッセイを紹介します。GTPase反応液中の残存GTPを検出する手法により、GTPase、GAPおよびGEFの活性が測定可能です。精製酵素だけでなく、細胞ライセートからプルダウンした酵素でのアッセイも可能なため、基礎研究からスクリーニングまで幅広く対応しています。
#2087 Miniaturization of a Bioluminescent PD-1PD-L1 Blockade Bioassay
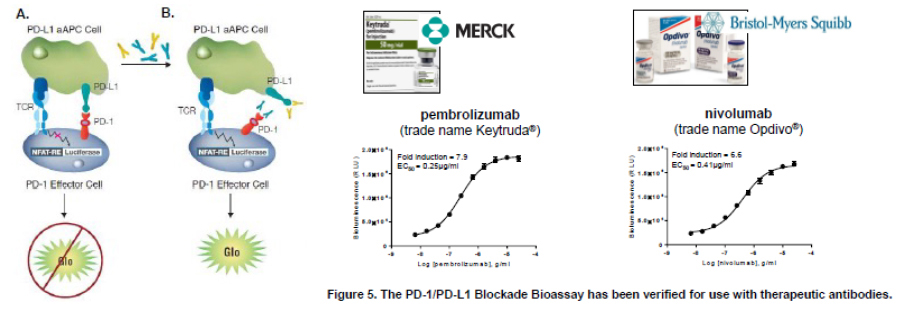
近年、がん治療薬として免疫チェックポイントのブロック抗体の開発が進んでいます。特にPD-1/PD-L1の抗体はこの分野の先駆けであり、より良い抗体を求めて開発競争が盛んです。このポスターでは発光法を用いたレポーターベースの抗PD-1/PD-L1抗体評価アッセイを紹介します。アッセイ系構築だけでなくプロトコールの改良も行い、細胞培養不要なThaw-and-Useフォーマットを使用することで、再現性や信頼性を向上させました。品質管理から抗体スクリーニングまで幅広く使用できるアッセイです。
#2127 Intracellular Target Engagement Enabled by NanoLuc Luciferase Chemistries
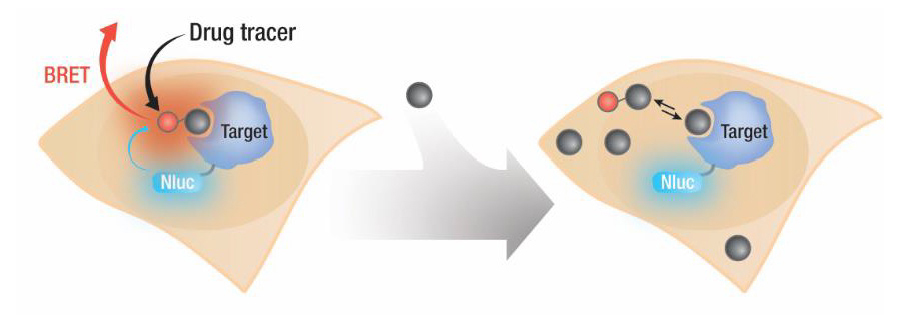
薬物と細胞内標的分子との物理的な結合評価をtarget engagementといいます。創薬の過程において、細胞内でのtarget engagementは重要です。target engagementにより、化合物の細胞膜透過性、結合親和性、カイネティックな結合・解離率を評価できます。これまで細胞でのtarget engagementの測定は技術的に難しいとされてきました。ここではBRETを用いた生細胞内での物理生物学的手法でtarget engagementを行う方法を紹介します。この手法では以下の4つの材料を用いてアッセイを行います。
- 細胞内で発現するターゲットタンパク-NanoLuc融合体
- 細胞膜透過性の蛍光トレーサー
- NanoLuc基質 (Furimazine)
- 細胞外NanoLuc阻害剤
#4025 Measuring Intracellular Target Engagement via BRET with Stable Cell Lines
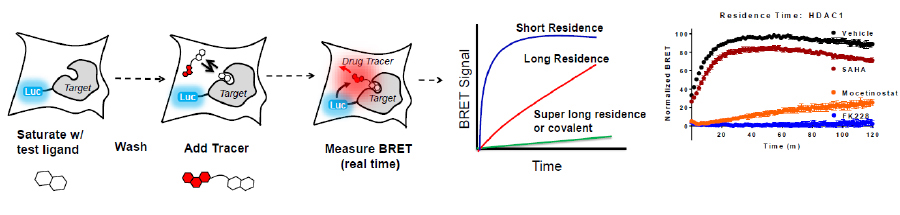
レジデンスタイムの測定原理および測定例
これまで化合物の細胞膜透過性、結合親和性、カイネティックな結合率の測定は技術的に難しいとされてきました。プロメガはこれらのパラメーターについて、BRET法を用いたターゲットエンゲージメントアッセイ法により、生細胞において直接的に測定する方法を提案します。このBRETベースの方法は複数のキードラッグターゲットクラス、HDACs、ブロモドメイン、キナーゼに対応しています。ここではHDACターゲットエンゲージメントのアプリケーションを紹介します。
#5000 NanoBRET Target Engagement and Acoustic Dispensing Technologies
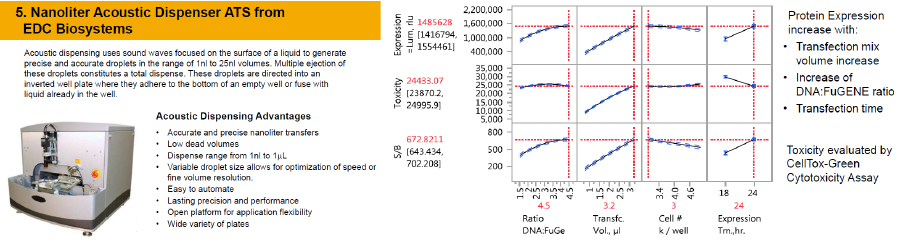
微量分注機とFuGENE HDとCellToxGreenを
用いた微量トランスフェクションと毒性評価
ターゲットエンゲージメントアッセイのHTSへの応用例として、微量分注機の使用例を紹介します。ベクターのトランスフェクション、基質などの添加を自動分注によりtarget engagement の操作をシンプルにし、HTSを実現できます。
#5017 NanoBRET Implementation in HTS For Drug Discovery
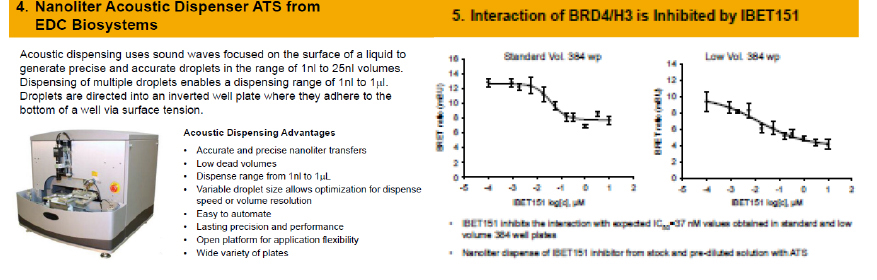
創薬研究において、PPIにおける低分子モジュレーター、阻害剤、活性化剤の同定は難しいとされてきました。これは主にこの同定を行う際のHTSツールの開発の難しさによるものです。従来のBRETは細胞内のリアルタイムのPPIを検出する方法として開発されましたが、狭いダイナミックレンジと感度の限界が課題となっていました。ここでは超微量分注機を用いたNanoBRETの応用例として、bromodomain/histoneとp53/Mdm2 transcriptional protein interactionsの阻害剤スクリーニング、EFGR/GRB2 membrane interactionとcRaf/bRaf signaling pathwayの活性化剤スクリーニングの例を紹介します。
#2086 New Bioluminescent Assays Enable Easy Measurement of Glucose-Dependent Metabolic Pathways
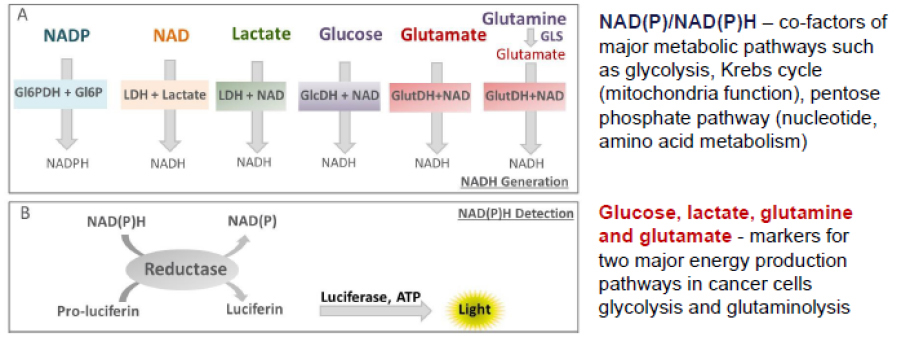
細胞は恒常性の維持のため、常にエネルギーや核酸、脂質などの合成が行われており、グルコースやグルタミンなどは重要な合成材料です。我々はNAD(P)/NAD(P)Hと各代謝物特異的な還元酵素および発光測定技術を組み合わせることで、グルコース、乳酸、グルタミン酸、そしてグルタミンの4つの代謝物を測定可能な技術を開発しました。あわせて、発光測定の利点である、高感度および低バックグラウンドによる代謝物の変化の測定が可能です。
#2106 An Environmentally-Controlled Microplate Reader with Injector Enables Walk-Away Monitoring of Cytotoxicity, Viability and Apoptosis
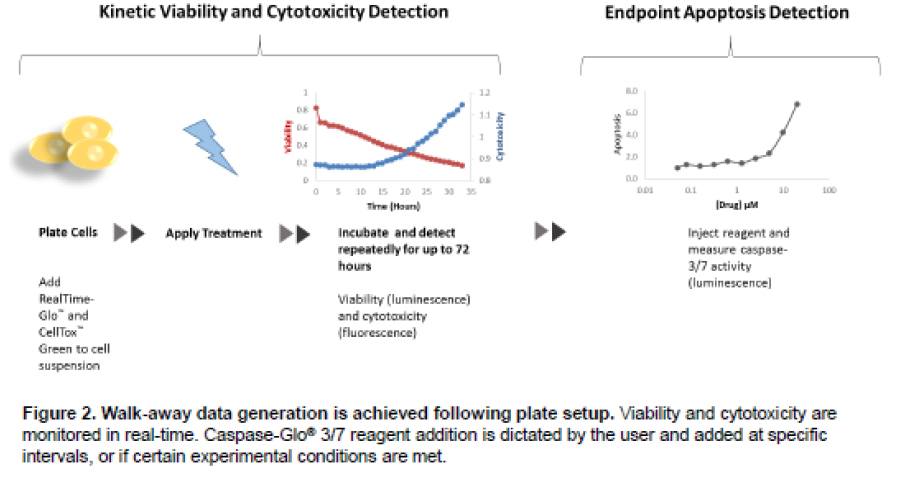
化合物評価においては適切な時間内やタイミングでの評価が求められます。今回、我々はマルチ検出モードマイクロプレートリーダーTecan Spark™ 10M Microplate Readerを用いて、化合物添加による細胞生存性と細胞毒性、およびカスパーゼ3/7の活性の変化を評価しました。今回使用した細胞生存性試験試薬と細胞毒性試験試薬は72時間までの経時的な情報の取得が可能であり、細胞毒性の指標の増加とカスパーゼ3/7の活性の増加のタイミングが一致していました。また、自動分注装置を用い、細胞毒性の指標が一定値を超えた際に、カスパーゼ活性が評価されるプログラムを作成し、6種の既知のキナーゼ阻害剤の作用機序を評価しました。
#2107 A Bioluminescent Assay Enables Easy Measurement of Glucose Uptake Metabolic Pathways
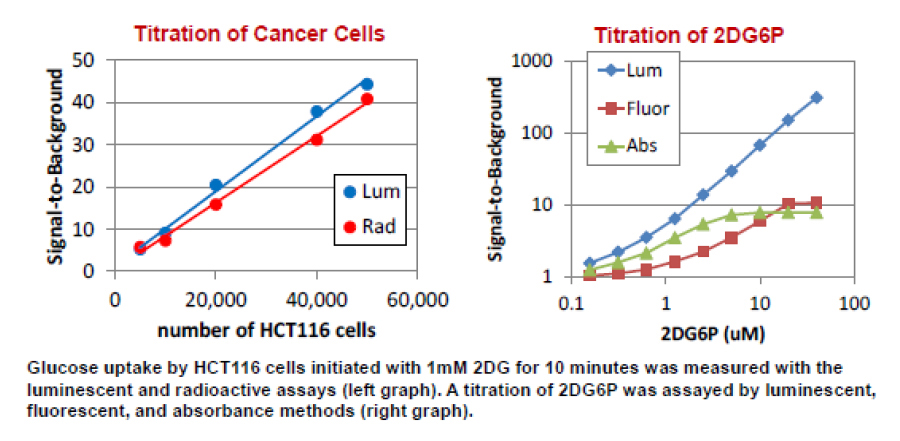
がんや糖尿病などの疾患においてグルコースの取り込み能の異常が見られており、グルコースの取り込みの制御は、創薬を含めた代謝研究において重要な標的の1つです。 グルコースの取込み量の測定は、主に2-デオキシグルコース(2DG)やその類縁体 を用いて、放射性標識、蛍光または吸光による方法で行われています。我々はルシフェラーゼの発光技術を活用し、グルコースの取り込み能を高感度に評価する技術を開発しました。発光法での測定は放射性標識と同等の感度を示し、蛍光や吸光よりも高感度な測定が行うことが可能でした。加えて、同一ウェルでの細胞生存試験が同時にアッセイ可能でした。従来法と比較し、発光法での測定ではより簡便に高感度なグルコースの取り込み能の評価が可能です。
#4027 Multiplexing a Real-Time Cell Viability Assay and RNA Extraction from the Same 3D Spheroids
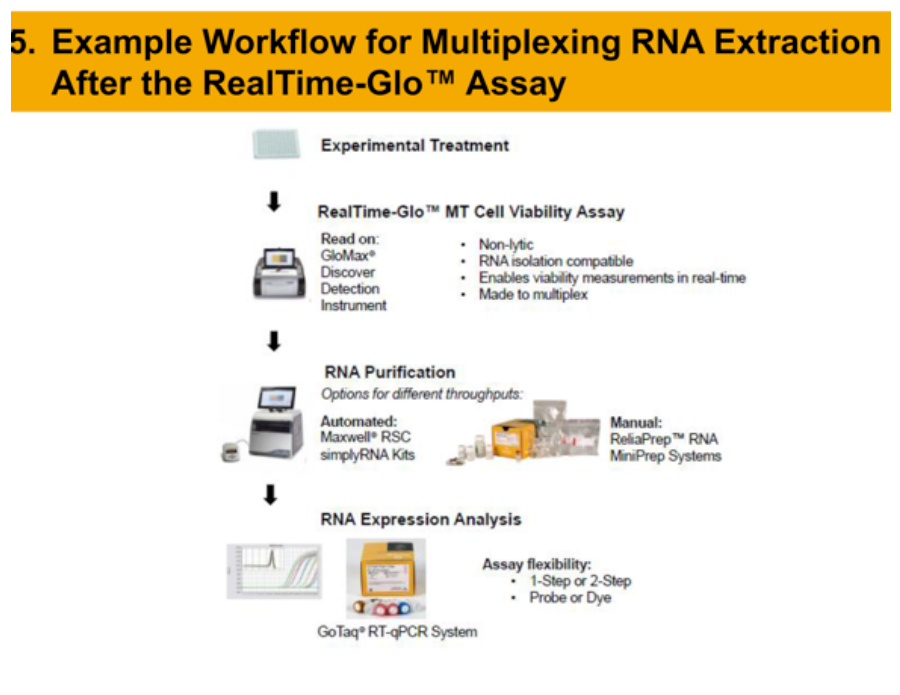
昨今、2次元培養と生体内の差を埋めるアッセイ系として3次元培養法に注目が高まっており、様々な3次元培養の技術が開発されています。ただ、形成された3次元構造により、従来のin vitroアッセイ試薬では評価が 不十分な場合があります。今回、我々はNanoLucルシフェラーゼを応用したRealTime-Glo™ Assay systemにより、3次元培養法サンプルの生細胞性試験とRNA精製、および最大72時間までの経時的な生細胞性試験結果を示しました。また、非溶解性アッセイであるRealTime-Glo™ Assay systemを活用し、経時的な生細胞性試験と同時にアポトーシスやレポーターアッセイなどの複数のアッセイ例も示しました。RealTime-Glo™ Assay systemでは同一プレートで細胞の状態を経時的に確認しつつ、複数の情報の取得が可能であり、薬剤開発において柔軟性をもたらすことが可能です。
